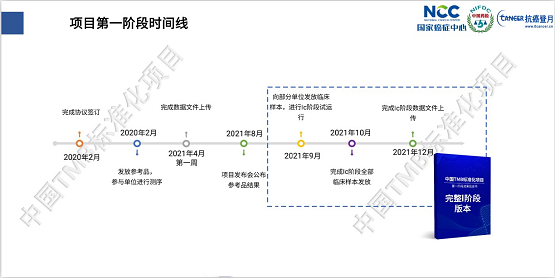
2021年8月28日,在国家癌症中心肿瘤病理诊断新进展研讨会暨第七届中美肿瘤诊断病理论坛期间,中国TMB标准化项目1第一阶段成果正式发布。发布会上,由项目组各位专家汇报了第一阶段的工作成果,介绍了成果蓝皮书的内容框架。

发布会由国家癌症中心/中国医学科学院肿瘤医院病理科主任应建明教授主持,并特邀中国抗癌协会肿瘤病理专业委员会第四届主任委员步宏教授、第五届主任委员杜祥教授、国家癌症中心/中国医学科学院肿瘤医院河北医院院长李宁教授以及中国食品药品检定研究院非传染病诊断试剂室主任黄杰教授分别为本次成果发布会致辞。
中国医学科学院肿瘤医院病理科主任应建明教授主持线上会议
步宏教授提到:“TMB是备受关注的生物标志物,但其预测价值尚未形成共识,究其原因,可能与检测的标准和规范不统一有关。中国TMB标准化项目是很好的探索,所有参与单位的合作共赢是项目的基本宗旨。”
杜祥教授表示:“这是一个跨系统、跨领域、参与单位非常多的项目,非常不容易,祝贺项目有很好的进展,如果未来可以形成国家标准,对未来的临床工作会有更大的促进作用。”
李宁教授对项目做出高度评价:“国家癌症中心的使命是提高中国肿瘤的诊断和治疗的标准化和规范化水平,TMB项目契合了我们这两个使命。把标准制订好,就可以基于TMB检测做好相应的诊疗,具有引领性的价值和意义!”
黄杰教授表示:“这是第一次中检院和临床机构合作来推动生物标志物的检测标准化及质量控制,跟病理行业合作也是首次。希望以此为契机,后期在临床应用的肿瘤检测标准化工作中有更多的合作。”
会议开始,复旦大学石乐明教授带来了题为《NGS标准化研究国际进展》的报告,向大家介绍了美国FDA于2004年发起的MAQC计划, 着重介绍了关于肿瘤NGS检测标准化方面的内容与成果,让听众全面了解肿瘤NGS检测标准化研究的国际趋势和重要进展。

复旦大学石乐明教授做报告《NGS标准化研究国际进展》
应建明教授做了题为《中国TMB标准化项目第一阶段总体结果(1A-1B)及1C计划》的报告,回顾了项目的整体目标以及自去年10月18日启动会以来的项目历程。报告重点发布了对各参与单位在点突变探测准确度和TMB检测能力的评估结果,着重分析了对TMB检测产生影响的诸多因素,其中样本的肿瘤细胞纯度是在诸多影响因素中权重最大 的,应教授强调在NGS检测前对样本进行病理质控和肿瘤纯度的确定是非常必要的。在报告的结尾,他提醒所有的参与单位:TMB项目马上进入更为关键的临床样品测序(1C)阶段,并介绍了该阶段的主要目标和计划。
中国医学科学院肿瘤医院应建明教授做报告《第一阶段总体结果(1A-1B)及1C计划》
应教授提到:项目1B阶段结束后,项目组评估了各参与单位的质控性能、位点检出性能,以及TMB计算能力,建立了可复用的肿瘤NGS 大panel评估体系,并将成果编辑整理形成《中国TMB标准化项目第一阶段成果蓝皮书》。今天发布的1A-1B的结果已经写入了蓝皮书,在审校之后将在年底的国家癌症中心年会上正式跟大家见面。

《中国TMB标准化项目第一阶段成果蓝皮书》
黄杰教授做了题为《中国TMB标准化项目第一阶段:中检院参考品分析结果(1B)》的报告。报告中重点发布了各单位运用其大Panel检测产品对参考品进行测序后,各种质量评估结果及TMB检测相关性的评估结果,并通过分析总结出中国大Panel产品的设计特点及可能给TMB检测带来的影响。黄教授还介绍了目前TMB标准化项目中构建的参考品及相关评估体系:包括1)参考细胞系、2)通过NGS生成的高深度WES数据集、 3)通过生信方法分析得到的高可信的点突变数据库及相应的TMB标准值 、4)正在搭建的可复用的数据分析和评估平台(抗癌登月:https://www.0cancer.cn/tmbnews/public/)。

中国食品药品检定研究院黄杰教授做报告《中检院参考品分析结果(1B)》
专家寄语:
中国抗癌协会肿瘤病理专委会主任委员 刘艳辉教授:
很高兴见证蓝皮书中重要结果的发布!国外的LDT法规和监管框架比较成熟,陆续开展了涵盖TMB评估的肿瘤NGS大panel检测,而我们还处于逐步完善阶段,本项目的目标,就是建立评估TMB大panel标准化检测流程和评估体系,中国抗癌协会肿瘤病理专委会对项目寄予厚望并大力支持,相信在专家组的指导和业界同仁通力合作支持下,一定会产生丰硕的成果。
中国食品药品检定研究院非传染病诊断试剂室主任 黄杰教授:
第一次和临床机构一起参与这么大规模的标准化项目。在这个过程中,我看到了临床机构及产业界对标准化的需求:从多靶标联合检测及多组学联合检测层面看,产品设计开发、监管落地、最终产品的实际应用、质量管理等整个链条的标准化操作流程,需要有更多的关于标准化制定的工作,呼吁大家积极参与和支持!
复旦大学附属肿瘤医院病理科副主任 周晓燕教授:
很高兴今天看到了既翔实又直观的成果,真切了解到了TMB检测的受控因素,对于后续临床样本的回顾性及前瞻性临床药物的使用、cut-off值的制定,都是非常重要的基础。这项工作对于其他标志物的规范也是一个借鉴,比如HRD等。这是一个多中心、多学科、跨领域合作的项目模式,可以得到更为重要的结果。
西安交通大学、 叶凯教授:
非常高兴可以把相关知识和技能应用在临床检测的标准化工作中,后续还有很多工作要做,比如在不同纯度下TMB的计算,我们需要纳入更多的参数,运用更好的计算手段,前面的几轮计算会不断的迭代、优化,使得更加贴近临床,切实的让临床检测变得标准化,服务于患者。期待我们一起做出自己的贡献!
北京大学生命科学学院、统计科学中心、生物信息中心研究员 李程博士:
就项目而言,这是一个长期的、任重道远的事情,不是一个短期完成的工作。TMB应用到临床还需要有长期的跟踪和预后的关联,可能是需要至少5年的评估的。项目的许多分析工作都是志诺维思在做,如果把更多的国内生物信息的同行吸引进来,对整个项目是有帮助的。
广东省肺癌研究所所长张绪超教授:
TMB检测在美国已经有验证,并且已经有LDT项目在FDA获批了,我们如何在国际上做到可信可靠,具有一定的挑战性。我们看到了初步的数据结果,跟MAQC的结果有非常类似的地方,性能表现是非常符合规律的。希望项目能够产生一套可用标准,对于国家管理机构、临床单位来说,都是能服务于患者的好事。
志诺维思(北京)基因科技有限公司创始人&CEO 凌少平博士:
志诺维思作为项目唯一的独立的数据分析和技术支持单位,深感责任重大。在大概6个多月的时间内,总共处理了约30T的数据,从标准集的建立到后续的分析,我们严格按照工作组专家指导意见进行。这种标志物的应用评估及标准建立,是国家精准医学发展所需,我们希望与大家一道把项目继续推动下去。
注1:中国TMB标准化项目(China TMB Harmonization Project)于2020年10月18日,由国家癌症中心、中国食品药品检定研究院与中国抗癌协会肿瘤病理专业委员会共同发起,是一项由临床医生发起,旨在完成TMB临床验证获得临床证据并推动临床应用的标准化研究项目。
项目拟通过对TMB在肿瘤免疫治疗临床应用中所涉及的相关问题进行全面考察和分析,完成对不同基因检测产品的分析和评估工作;建立TMB计算方法在不同类型检测方法与全外显子组(WES)之间的转换关系;应用临床试验样本,结合随访数据,划定不同癌种免疫治疗的TMB最佳获益基线,建立TMB临床检测标准及评估体系。
项目在方案流程上,参考了FoCR及QuIP的项目积累的经验,同时根据中国临床检测的实际情况进行了大量的优化调整。项目总共分为两个阶段,第一阶段是中国TMB检测现状调研与能力评估,第二阶段是各癌种TMB临床获益评估与基线建立。

